Введение.
Азотная кислота - высококоррозионный и мощный окислитель, играющий важнейшую роль в различных отраслях промышленности. Благодаря своим отличительным свойствам и широкому спектру применения, важно понимать ее химические и физические свойства, методы синтеза, универсальные способы использования, а также правила безопасности при обращении и хранении. Эта статья погружает в мир азотной кислоты, предоставляя ценные сведения как для профессионалов, так и для энтузиастов.
Внешний вид азотной кислоты.
Азотная кислота: Химические и физические свойства.
Азотная кислота, химически обозначаемая как HNO3, является высококоррозионным и мощным окислителем, обладающим целым рядом отличительных химических и физических свойств. Представляя собой бесцветную жидкость с сильным и резким запахом, она хорошо растворима в воде, что приводит к образованию ее широко известного водного раствора "аква фортис". Азотная кислота классифицируется как сильная монопротонная неорганическая кислота, то есть при растворении в воде она отдает один протон (H+).
Чистая азотная кислота имеет плотность около 1,51 г/см³ и температуру кипения 83 °C. Эти свойства делают ее очень летучим веществом, требующим осторожного обращения и хранения. Кроме того, благодаря своей сильной окислительной природе она способна легко принимать электроны от других веществ, что позволяет ей участвовать в широком спектре химических реакций. Азотная кислота известна своей реакционной способностью как с органическими, так и с неорганическими соединениями, что делает ее незаменимым реагентом в многочисленных химических процессах.
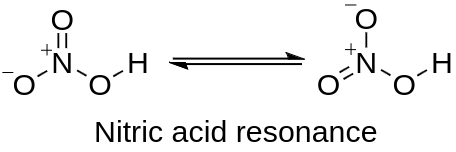
Резонанс азотной кислоты.
Азотная кислота обычно упоминается как сильная кислота при комнатной температуре. Существует некоторая дискуссия относительно значения константы диссоциации кислоты, при этом значение pKa обычно описывается как ниже -1. Это означает, что азотная кислота в ослабленном состоянии полностью диссоциирует, за исключением невероятно кислых растворов. Значение pKa возрастает до 1 при температуре 250 °C.
Кислотно-основные свойства азотной кислоты.
Азотная кислота может действовать как основание, если соединяется с кислотой, например серной:
HNO3 + 2H2SO4 ⇌ [NO2]+ + [H3O]+ + 2HSO-4;
Константа равновесия: K ≈ 22
Частица нитрония, [NO2]+, является динамическим реагентом в реакциях ароматического нитрования. Поскольку азотная кислота обладает как кислотными, так и щелочными свойствами, она может проходить через реакцию автопротолиза, соответствующую самоионизации воды:
2HNO3 ⇌ [NO2]+ + NO-3 + H2O
Благодаря своей коррозионной природе азотная кислота может вызывать серьезные повреждения различных материалов при контакте с ними. Она может разъедать металлы, органические соединения и даже некоторые пластмассы. Это коррозионное свойство объясняется ее способностью отдавать протоны и вступать в реакцию с материалами посредством кислотно-основных реакций. Поэтому при работе с азотной кислотой необходимо соблюдать осторожность, чтобы предотвратить несчастные случаи и повреждение оборудования.
Реакции азотной кислоты с металлами.
Известно, что азотная кислота взаимодействует практически со всеми металлами, причем скорость реакции зависит от концентрации кислоты и типа металла. Разбавленная азотная кислота проявляет характерное поведение кислоты при контакте с большинством металлов, например, с магнием, марганцем и цинком, с выделением водорода:
Mg + 2HNO3 → Mg(NO3)2 + H2
Mn + 2HNO3 → Mn(NO3)2 + H2
Zn + 2HNO3 → Zn(NO3)2 + H2
Азотная кислота способна окислять неметаллы, которые не являются реакционноспособными. Продукты, образующиеся при реакции с этими металлами с меньшей электроположительностью, зависят от температуры и концентрации кислоты. Например, при воздействии разбавленной азотной кислоты при комнатной температуре происходит реакция со стехиометрией 3:8:
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O.
Кроме того, выделяющийся оксид азота может реагировать с атмосферным кислородом, образуя диоксид азота. При более высоких концентрациях азотной кислоты диоксид азота образуется напрямую со стехиометрией 1:4:
Cu + 4H+ + 2NO-3 → Cu2+ + 2NO2 + 2H2O
Некоторые элементы превращаются в нитраты, например, олово (Sn), мышьяк (As), сурьма (Sb) и титан (Ti), которые преобразуются в SnO2, As2O5, Sb2O5 и TiO2 соответственно.
Драгоценные металлы, такие как золото и некоторые металлы платиновой группы, нетоксичны для кислоты, хотя она может разъедать серебро и другие менее благородные металлы, присутствующие в некоторых золотых сплавах. Азотная кислота также может использоваться для изменения цвета поверхности сплава, что позволяет выявить низкую концентрацию золота.
Сильные окислительные свойства азотной кислоты позволяют ей вступать в реакцию с большинством неметаллических соединений, и такие реакции могут приводить к образованию взрывоопасных конечных продуктов. В редких случаях благородные металлы, некоторые сплавы и восстановленные металлы могут быть невосприимчивы к воздействию азотной кислоты. Обычно высокая концентрация азотной кислоты приводит к образованию диоксида азота в результате окисления, а присутствие небольшого количества азотной кислоты (HNO2) ускоряет эту реакцию.
Хотя железо, хром и алюминий могут растворяться в разбавленной азотной кислоте, концентрированная азотная кислота приводит к образованию защитного пассивирующего слоя между металлом и кислотой, который называется пассивацией. Пассивация металлов азотной кислотой наблюдается у таких элементов, как железо, кобальт, хром, никель и алюминий, при концентрациях, которые обычно находятся в диапазоне от 20 до 50 % по объему.
Реакции с неметаллами.
Азотная кислота - грозный окислитель, взаимодействующий со многими органическими материалами и способный вызывать взрывные реакции. Гидроксильные группы обычно удаляют водород из органической молекулы, образуя воду, а нитрогруппа вытесняет водород. Нитрование органических веществ азотной кислотой - основной способ производства различных взрывчатых веществ, таких как нитроглицерин и тринитротолуол (TNT). Поскольку при этом может образовываться множество невероятно нестабильных побочных продуктов, эти химические процессы требуют регулирования температуры и отбрасывания побочных продуктов для получения желаемого продукта.
Когда кислота не находится в контакте с металлическими элементами, кроме азота, кислорода, инертных газов, кремния и галогенов, не включая йод, компоненты обычно окисляются до состояния наивысшей степени окисления, образуя кислые соли плюс диоксид азота в концентрированной кислоте и оксид азота в слабой кислотности.
C (graphite) + 4HNO3 →CO2 + 4NO2 + 2H2O;
3C (graphite) + 4HNO3 → 3CO2+ 4NO + 2H2O.
Концентрированная азотная кислота окисляет I2, P4 и S8, соответственно, в HIO3, H3PO4 и H2SO4. Она вызывает окисление графита и некристаллического углерода, но не реагирует с алмазом; она может отделить алмаз от графита, который она окисляет.
Синтез азотной кислоты.
Азотная кислота образуется в результате синтеза диоксида азота (NO2) и воды.
4NO2 + 2H2O→ 2HNO3 + NO + NO2 + H2O
Общая реакция выглядит следующим образом:
3NO2 + H2O → 2HNO3 + NO
Как правило, образовавшийся в результате реакции оксид азота восстанавливается до исходной формы путем окисления кислородом, содержащимся в атмосфере, что приводит к образованию дополнительного диоксида азота.
Введение диоксида азота через пероксид водорода может способствовать увеличению количества образующейся кислоты.
2NO2 + H2O2 → 2HNO3
Обычная концентрация азотной кислоты в промышленных масштабах обычно составляет от 52% до 68%. Вильгельм Оствальд, немецкий химик, придумал название "процесс Оствальда" для производства азотной кислоты. Этот процесс включает в себя окисление безводного аммиака для получения оксида азота с помощью платинового или родиевого катализатора при температуре около 227 °C и давлении 9 атмосфер (910 кПа).
4NH3(г) + 5O2(г) → 4NO(г) + 6H2O(г) (ΔH = -905,2 кДж/моль)
Затем оксид азота взаимодействует с кислородом из атмосферы, в результате чего образуется диоксид азота.
2NO(г) + O2(г) → 2NO2(г) (ΔH = -114 кДж/моль)
После этого он попадает в воду, в результате чего образуются азотная кислота и оксид азота.
3NO2(г) + H2O(л) → 2HNO3(aq) + NO(г) (ΔH = -135,74 кДж/моль)
Оксид азота может быть переведен обратно в окисленную форму, если последний этап происходит в кислородсодержащей атмосфере:
4NO2(г) + O2(г) + 2H2O(л) → 4HNO3(aq)
Полученная HNO3 в жидком виде может быть увеличена в концентрации примерно до 68% по массе путем дистилляции. Дегидратация с помощью сильной H2SO4 может повысить концентрацию еще больше, до 98 %. На этом этапе конечный продукт может быть синтезирован из азота, водорода и кислорода, которые поступают из воздуха и природного газа. В процессе преобразования используется аммиак, который можно получить по методу Хабера.
Лабораторный синтез.
В лаборатории азотная кислота может быть получена путем разрушения нитрата меди(II) под действием тепла с образованием диоксида азота и кислорода, которые затем пропускаются через воду с образованием азотной кислоты.
2Cu(NO3)2 → 2CuO + 4NO2 + O2
Затем, следуя процессу Оствальда:
2NO2 + H2O→ HNO2 + HNO3
В качестве альтернативы можно соединить равное молярное количество любой нитратной соли, например нитрата натрия, с серной кислотой (H2SO4), а затем выпарить эти компоненты при температуре кипения азотной кислоты 83°C. Грубый остаток металлического сульфата водорода остается в перегонной емкости. Бордовую дымящуюся азотную кислоту можно превратить в бесцветную азотную кислоту.
NaNO3 + H2SO4 → HNO3 + NaHSO4
Разбавленный NOx может быть просто удален путем снижения давления при комнатной температуре (примерно 10-30 минут при 200 мм рт. ст. или 27 кПа), в результате чего образуются белые пары азотной кислоты. В качестве альтернативы, снизив температуру и давление, этот процесс можно провести за одну стадию, избежав образования диоксида азота.
Чтобы довести концентрацию азотной кислоты до 68%, в лаборатории проводят дистилляцию в сочетании с серной кислотой или нитратом магния в качестве сушильного агента. В качестве меры предосторожности перегонку следует проводить при низком давлении, чтобы остановить разложение кислоты. Кстати, в промышленном производстве высококонцентрированную азотную кислоту получают, соединяя диоксид азота с 68%-ной азотной кислотой в абсорбционной колонне. От того, останутся ли оксиды азота в растворе или испарятся во время процедуры, зависит, останутся ли в результате белые или красные пары азотной кислоты. В последнее время для получения безводной кислоты из концентрированной азотной кислоты используются электрохимические методы.
Универсальное применение азотной кислоты в различных отраслях промышленности.
Азотная кислота находит широкое применение в различных отраслях промышленности благодаря своим универсальным свойствам. Некоторые из основных областей применения включают:
Производство удобрений: Азотная кислота является жизненно важным компонентом при производстве аммиачной селитры, широко используемого удобрения. Она обеспечивает необходимый азот для роста растений, повышая урожайность и общую производительность сельского хозяйства.
Взрывчатые вещества и пропелленты: Азотная кислота используется в производстве взрывчатых веществ и ракет. Она является ключевым ингредиентом при производстве динамита, тротила и других мощных взрывчатых веществ. В аэрокосмической промышленности она используется для производства ракетного топлива.
Синтез TNT.
Металлургия: Азотная кислота играет важную роль в процессах рафинирования и травления металлов. Она используется для растворения и очистки таких металлов, как золото и серебро, а также для травления рисунков на металлических поверхностях.
Красители и пигменты: Азотная кислота участвует в производстве красителей, пигментов и красящих веществ. Она используется в синтезе различных органических соединений, в том числе анилиновых красителей, которые находят применение в текстильной промышленности.
Фармацевтика и лабораторные исследования: Азотная кислота используется в фармацевтической промышленности для синтеза различных лекарств и фармацевтических промежуточных продуктов. Она также является важным реагентом в лабораторных условиях для химического анализа и исследовательских целей.
Обеспечение безопасности при работе с азотной кислотой: Обращение, хранение и меры защиты.
Из-за своей коррозийной и опасной природы обращение с азотной кислотой и ее хранение требуют соблюдения строгих правил безопасности. Вот некоторые важные меры по обеспечению безопасности:
Средства индивидуальной защиты (СИЗ): При работе с азотной кислотой необходимо использовать соответствующие СИЗ, включая защитные очки, перчатки, лабораторные халаты и обувь с закрытыми носками. Это защитит глаза, кожу и органы дыхания от возможного контакта или вдыхания.
Вентиляция: Работа с азотной кислотой должна проводиться в хорошо проветриваемых помещениях или под вытяжными шкафами, чтобы предотвратить накопление опасных паров. Достаточная вентиляция помогает поддерживать безопасную рабочую среду.
Хранение: Азотную кислоту следует хранить в плотно закрытых контейнерах из совместимых материалов, таких как стекло или полиэтилен высокой плотности (HDPE). Места хранения должны быть прохладными, сухими и находиться вдали от прямых солнечных лучей. Важно хранить азотную кислоту отдельно от несовместимых веществ, чтобы предотвратить реакцию и потенциальную опасность.
Обращение и пролив: С азотной кислотой следует обращаться осторожно, избегая попадания на кожу и в глаза. В случае разлива необходимо иметь под рукой соответствующие комплекты для ликвидации разливов, а разливы следует быстро убирать с помощью нейтрализующих средств и надлежащих методов утилизации.
Заключение.
В заключение следует отметить, что глубокое понимание химических и физических свойств азотной кислоты имеет решающее значение для безопасного использования ее универсальности и силы в различных отраслях промышленности. Соблюдая правила обращения, хранения и меры защиты, профессионалы могут создать безопасную рабочую среду, максимально используя преимущества азотной кислоты. Учитывая ее коррозионную активность и реакционную способность, а также соблюдая правила безопасности, люди могут эффективно использовать азотную кислоту для достижения прогресса в таких областях, как металлургия, производство взрывчатых веществ и фармацевтика. Благодаря постоянным исследованиям и соблюдению правил безопасности можно использовать потенциал азотной кислоты для достижения прогресса и инноваций в различных отраслях.