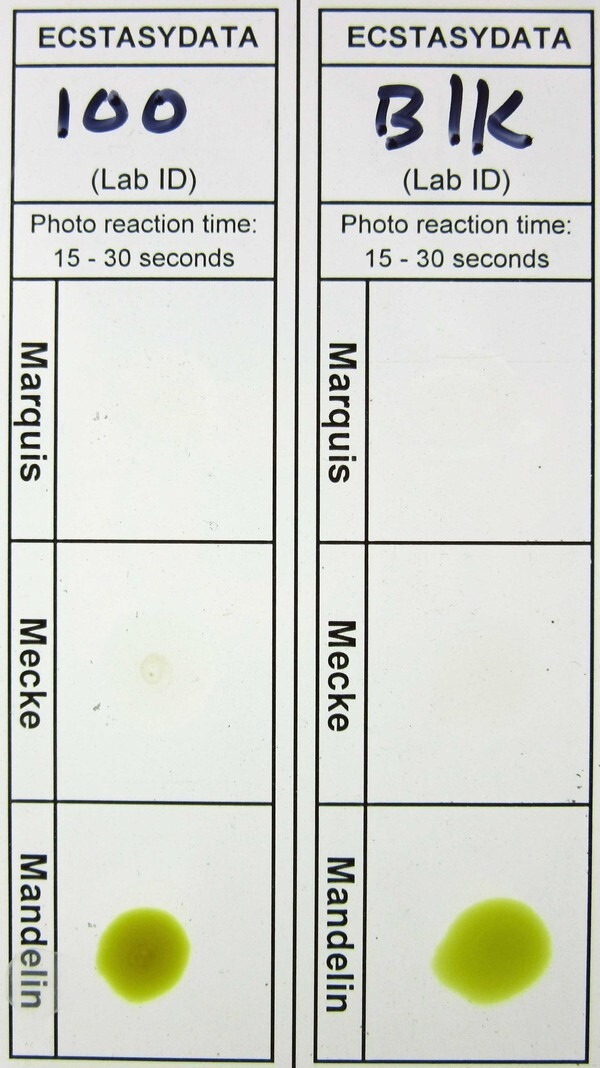
Тонкослойная хроматография (ТСХ) лекарств.
Введение.
Хроматография используется для разделения смесей веществ на составляющие их компоненты. Все виды хроматографии работают по одному и тому же принципу. В этой статье я объясню этот метод, определив Rf амфетамина, метамфетамина и мефедрона.
Хроматографические пластины имеют стационарную фазу (твердое вещество или жидкость, закрепленная на твердом веществе) и подвижную фазу (жидкость или газ).
Подвижная фаза проходит через неподвижную фазу и переносит с собой компоненты смеси. Разные компоненты перемещаются с разной скоростью. Причины этого мы рассмотрим далее на странице. Тонкослойная хроматография выполняется точно так же, как и написано, - с помощью тонкого равномерного слоя силикагеля или глинозема, нанесенного на кусок стекла, металла или жесткого пластика. Силикагель (или глинозем) - это стационарная фаза. Стационарная фаза для тонкослойной хроматографии также часто содержит вещество, которое флуоресцирует в ультрафиолетовом свете или в йодной камере - по причинам, которые вы увидите позже. Подвижная фаза - это подходящий жидкий растворитель или смесь растворителей.
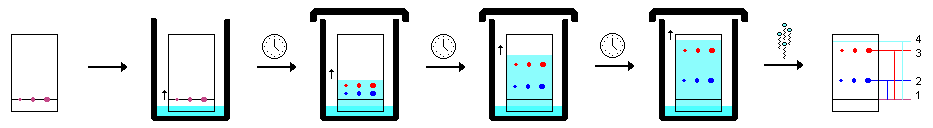
Как работает тонкослойная хроматография?
Силикагель - это разновидность диоксида кремния (кремнезема). Атомы кремния соединены через атомы кислорода в гигантскую ковалентную структуру.
Однако на поверхности силикагеля атомы кремния присоединены к группам -OH. Таким образом, на поверхности силикагеля вместо связей Si-O-Si имеются связи Si-O-H. На диаграмме показана небольшая часть поверхности силикагеля. Поверхность силикагеля очень полярна и, благодаря группам -OH, может образовывать водородные связи с подходящими соединениями вокруг него, а также дисперсионные силы Ван-дер-Ваальса и диполь-дипольные притяжения.
Подготовка.
Вам потребуется:
1. Шприц на 5 мл х 4
2. Пластиковая баночка для анализа мочи х 4
3. Большие пластиковые контейнеры для еды (или один большой стакан и пластиковый контейнер) х 2
4. Пластина для ТСХ со слоем силикагеля 5х10 см (большую можно разрезать ножницами)
5. Растворители этилацетат, метанол, гексан (можно заменить четыреххлористым углеродом), водный раствор аммиака 10% или выше, спиртовой раствор йода
6. Мягкий карандаш, линейка и плоскогубцы
Не забудьте про перчатки и респиратор, проводите эксперимент в проветриваемом помещении.
Получение хроматограммы.
1. Необходимо приготовить жидкий раствор этилацетат:метанол:раствор аммиака 85:10:5. На 10 мл необходимо взять 8,5 мл этилацетата, 1 мл метанола и 0,5 мл раствора аммиака и перемешать.

2. Очистите пластину с силикагелем от этого раствора. Поместите пластину в раствор на глубину 3-4 мм в большой мензурке. Для удобства манипуляций можно использовать пинцет.
Важно: не смачивайте пластину водой, так как она будет испорчена. Держите пластину в растворе до тех пор, пока растворитель не дойдет до верхнего края пластины.
3. Начнем с простого случая. Есть четыре вещества: амфетамин (A), метамфетамин (L), кофеин (K) и мефедрон (M).
Для этого эксперимента вам нужно получить свободную основу наркотиков. Поместите 10-15 мг образца (несколько комочков) в стеклянную (пластиковую) банку, прилейте две капли водного раствора аммиака. Затем прилейте 3-4 капли гексана или четыреххлористого углерода и встряхивайте в течение минуты. Свободное основание вашего препарата растворяется в органическом слое.


4. Теперь нужно поместить его на хроматографическую пластину, которая была подготовлена заранее. Возьмите иглу от шприца и обрежьте ее плоскогубцами, как показано на примере. У вас должен получиться ровный край.





Возьмите чистую и высушенную пластину и проведите карандашом линию на расстоянии ~5-6 мм вверх от нижнего края. Любые пометки на пластине, показывающие первоначальное положение капли, также должны быть сделаны карандашом. Если все это было сделано чернилами, то красители из чернил также будут перемещаться по мере развития хроматограммы. Отметьте четыре точки на одинаковом расстоянии друг от друга. Погрузите конец обрезанной иглы в органический слой первого наркотического раствора. Коснитесь пластины кончиком иглы и сделайте небольшое пятно диаметром 3-4 мм, подождите, пока оно высохнет, повторите процедуру 10 раз. Повторите этапы 2, 3 для других веществ.
Распространенная ошибка: не делайте большое жирное пятно, потому что ваше вещество может перекрыть другое вещество во время эксперимента.
5. Когда пятна свободных оснований высохнут, пластинку помещают в неглубокий слой растворителя в накрытом стакане. Важно, чтобы уровень растворителя был ниже линии, на которой находится пятно. Дождитесь, пока граница растворителя достигнет 4-5 мм до верхнего края пластины, и вытащите ее. После этого проведите карандашом линию по передней линии растворителя. Высушите ее на воздухе.


6. Хроматограмму помещают в закрытый контейнер (например, в другую мензурку, накрытую часовым стеклом, или в большой пластиковый контейнер) вместе с несколькими кристаллами йода. Пары йода в контейнере вступают в реакцию с пятнами на хроматограмме. Интересующие вас вещества могут проявиться в виде цветных пятен. Обведите их карандашом и нарисуйте точки в центре каждого пятна.

Также можно использовать УФ-лампу с длиной волны 254 и 365 нм.

Как подготовить йодную камеру.
Возьмите одну пластиковую или стеклянную банку, налейте в нее 10-15 мл воды, 4-5 капель спиртового раствора йода. Перемешивайте в течение 7-10 минут. Слейте воду. Йод выпадет в осадок в воде на стенках банки. Поместите банку в контейнер.
Коэффициент удерживания.
После завершения разделения отдельные соединения проявляются в виде пятен, расположенных вертикально. Каждое пятно имеет коэффициент удерживания (Rf), который равен расстоянию, пройденному растворителем, по сравнению с общим расстоянием, пройденным растворителем.
Формула Rf: Rf= расстояние, пройденное образцом/расстояние, пройденное растворителем.

Значение Rf может быть использовано для идентификации соединений благодаря его уникальности для каждого соединения. При сравнении двух различных соединений в одинаковых условиях, соединение с большим значением Rf является менее полярным, поскольку оно не прилипает к неподвижной фазе так долго, как полярное соединение, которое имеет меньшее значение Rf. На значения Rf и воспроизводимость может влиять множество различных факторов, таких как толщина слоя, влажность пластины ТСХ, насыщенность сосуда, температура, глубина проникновения подвижной фазы, природа пластины ТСХ, размер образца и параметры растворителя. Эти факторы обычно приводят к увеличению значений Rf. Однако в случае толщины слоя значение Rf уменьшается, поскольку подвижная фаза движется по пластине медленнее.
Обсуждение результатов.
В эксперименте я получил три пятна вместо ожидаемых четырех. Повторение эксперимента показало, что кофеин не элюируется раствором этилцетата:метанола:аммиака 85:10:5.
Экспериментально установлено, что этот раствор подходит для элюирования таких наркотиков, как амфетамин, метамфетамин и мефедрон.

Rf исследуемых препаратов.
Амфетамин - 0,53
Метамфетамин - 0,55
Мефедрон - 0,65
Пояснение.
У меня есть две пластины с результатами. Два измеренных расстояния между начальной точкой и серединой обведенного пятна. В первой пластине пятно амфетамина находится на расстоянии 42, а во второй - 49 мм от стартовой линии, передняя линия растворителя - 85 и 86 мм соответственно. Rf1=42/85=0.49, Rf2=49/86=0.52. Затем я вычислил среднее арифметическое 0,53. Такие же расчеты были проведены и для других веществ.
Выводы.
Как показывает эксперимент, вы можете измерить Rf вашего препарата и сравнить с известным веществом в той же пластине. Для проверки Rf сделайте пятно без основы вашего препарата и 1-4 пятна других препаратов. Если пятна находятся на одинаковом расстоянии от стартовой линии, то, вероятно, это одно и то же вещество.
Также если вы получили несколько пятен от вашего препарата, то, скорее всего, у вас смесь веществ. Некоторые препараты имеют несколько пятен, потому что представляют собой смесь лекарства и побочных продуктов синтеза.
Однако вы можете сравнить их с другими препаратами с помощью тонкослойной хроматографии.