Категории
Приложение
How to install the app on iOS
Follow along with the video below to see how to install our site as a web app on your home screen.

Примечание: this_feature_currently_requires_accessing_site_using_safari
Категории
Триптамины
-
This site is explicitly against the distribution of illegal substances and any illegal activity. The administration is not responsible for the content posted by users. The administration of the resource is monitoring the posted content and takes measures to prevent publications that potentially violate the law. You can submit a complaint on a publication through the dedicated feedback form.
Вы используете устаревший браузер. Этот и другие сайты могут отображаться в нём некорректно.
Вам необходимо обновить браузер или попробовать использовать другой.
Вам необходимо обновить браузер или попробовать использовать другой.
Обновить
Новое
Сортировка
Вид
Синтез псилоцина.
3-[2-(Диметиламино)-2-оксоацетил]-1H-индол-4-ил ацетат.
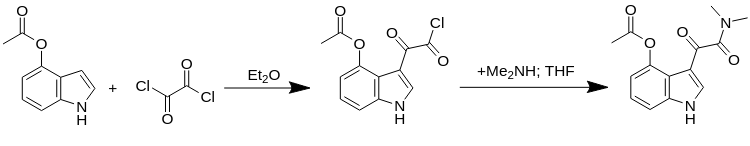

Процедура A:
Процедура B:

- В круглодонную колбу, оснащенную верхней мешалкой, регулятором температуры и капельной воронкой, добавили 1H-индол-4-илацетат (50,1 г, 285 ммоль, 1 эквив) и ангидрид Et2O (700 мл).
- Суспензию перемешивали в течение 10 мин, затем охлаждали до 0 *С на водяной бане со льдом в течение 30 мин.
- В капельную воронку поместили раствор оксалилхлорида (37,1 мл, 428 ммоль, 1,5 эквив.) в Et2O (60 мл).
- Раствор оксалилхлорида добавляли по каплям со скоростью, достаточной для поддержания температуры на уровне или ниже 5 *C, чтобы минимизировать образование димеров и других возможных побочных продуктов.
- По мере добавления образовывалась желтая суспензия, и после завершения добавления смесь перемешивали в течение 4 ч.
- По истечении этого времени добавили гептан (400 мл) и смесь перемешивали в течение 30 мин при 0 *С.
- Полученное желтое твердое вещество быстро отфильтровали и последовательно промыли гептаном (2х300 мл), который быстро растворили в THF (500 мл) и охладили до 0 *С.
- 2,0 М раствор диметиламина в THF (175 мл) добавляли по каплям со скоростью, достаточной для поддержания температуры ниже 5 *C, чтобы минимизировать побочные реакции.
- После завершения добавления пиридина (46 мл) в THF (100 мл) добавляли по каплям и смесь хорошо перемешивали в течение 60 мин.
- Добавили гептан (600 мл) и отфильтровали содержимое колбы через воронку Бюхнера.
- Отфильтрованный остаток переносят в круглодонную колбу, добавляют деионизированную H2O (1000 мл), перемешивают в течение 30 мин и фильтруют через воронку Бюхнера.
- Белое твердое вещество тритурировали последовательно в течение 40 мин в EtOAc (600 мл) и гептане (400 мл).
- Суспензию отфильтровали через воронку Бюхнера и твердое вещество высушили в печи при 40 *C в течение ночи, получив 6 в виде светло-желтого твердого вещества; выход: 66,1 г (81%).
3-[2-(Диметиламино)этил]-1H-индол-4-ол (псилоцин).

Процедура A:
- В круглодонную колбу, оснащенную верхней мешалкой, регулятором температуры и капельной воронкой, добавляют 3-[2-(диметиламино)-2-оксоацетил]-1H-индол-4-ил ацетат (31,5 г, 115 ммоль) и 2-CH3-THF (1000 мл).
- Колбу погрузили в ледяную баню при 0 *С и через капельную воронку добавили раствор 2,3 М LiAlH4 в 2-CH3-THF (140 мл, 322 ммоль).
- Капельная воронка была промыта дополнительным количеством 2-CH3-THF (20 мл). Раствор LiAlH4 добавляли по каплям со скоростью, обеспечивающей поддержание температуры ниже 20 *C.
- 4. После добавления смесь перемешивали в течение 30 мин.
- Светло-желтый раствор был нагрет до рефлюкса (80 *C) с помощью нагревательной мантии и приобрел цвет слоновой кости через 3 ч.
- На стенках круглодонной колбы наблюдалось накопление желтого твердого вещества.
- Нагревательную мантию убрали, а колбу охладили до 50 *C.
- Колбу снова охладили до 20 *C.
- Реакцию гасили последовательным добавлением 3 капель 1 М NaOH и 3 капель деионизированной H2O.
- Смесь разбавили THF (500 мл) и перемешивали в течение 20 мин.
- Смесь фильтровали через воронку Бюхнера, фильтрат хранили под N 2.
- Фильтровальную лепешку быстро перемешивали с 200 мл [10%-ного раствора (7% аммиака в MeOH) в CH2Cl2] и THF (500 мл).
- Фильтраты объединили и сконцентрировали, получив зеленое твердое вещество.
- Твердое вещество тритурировали с 1:1 EtOAc/гептан (50 мл), затем отфильтровали через воронку Бюхнера.
- Темно-зеленое твердое вещество сушили в печи при 40 *C в течение ночи, чтобы получить сухой псилоцин в виде темно-зеленого твердого вещества; выход: 20,7 г (91%); mp 167-169 *C.
Процедура B:
- Стадию восстановления проводили по аналогичному протоколу, описанному в процедуре А, используя 3-[2-(Диметиламино)-2-оксоацетил]-1H-индол-4-ил-ацетат (40,21 г, 135,2 ммоль) и 2,3 М LiAlH4 в 2-CH3-THF (188,1 мл, 432,5 ммоль).
- Реакцию гасили капельным добавлением THF/H2O (27:100, 50 мл) при скорости, поддерживающей температуру ниже 30 *C.
- Добавили ангидрид Na2SO4 (100 г), затем силикагель (50 г) и DCM (400 мл).
- Смесь перемешивали в течение 10 мин и отфильтровали через воронку Бюхнера.
- промыли смесью DCM/CH3OH (9:1, 1500 мл).
- Фильтраты объединили и сконцентрировали, получив светло-зеленое твердое вещество.
- Твердое вещество тритурировали с 1:1 EtOAc/гептан (50 мл), затем отфильтровали через воронку Бюхнера.
- Белое твердое вещество сушили в печи при 40 *C в течение ночи, чтобы получить сухой псилоцин в виде белого твердого вещества; выход: 21,6 г (77%).
Синтез псилоцибина.
Схема реакции:

2. Смесь перемешивали в течение 15 мин и погрузили колбу в охлаждающую баню с твердым CO2/ацетоном при -78 *C.
3. Когда внутренняя температура реакции достигла -67 *C, раствор 2,5M BuLi в гексанах (28,9 мл, 72,3 ммоль) добавляли по каплям в течение нескольких минут и поддерживали показания внутренней температуры ниже -60 *C.
4. После перемешивания оливково-зеленой реакционной смеси в течение 10 минут, тетрабензилпирофосфат (35,7 г, 66,2 ммоль) добавили одной порцией и смесь хорошо перемешали.
5. Через 1,5 ч баню с твердым CO2/ацетоном удалили и дали температуре медленно подняться до -25*C в течение 2 ч.
6. Аминосвязанный силикагель (30 г) добавили одной порцией и реакцию разбавили EtOAc (600 мл).
7. Темную смесь отфильтровали через прокладку Celite и промыли EtOAc (400 мл).
8. Кек повторно перемешивали в течение 10 мин с EtOAc (400 мл) и снова отфильтровывали.
9. Объединенные фильтраты концентрируют и переносят в 500 мл одногорлую круглодонную колбу.
10. Серое масло повторно растворили в DCM (100 мл) и нагревали с помощью тепловой пушки до кипения в течение 5 мин.
11. Колбе дали дойти до температуры rt и затем оставили на ночь при 4*C.
12. Неочищенный серовато-окрашенный осадок цвиттериона 9 отфильтровали через воронку Бюхнера, затем тритурировали с DCM (4x100 мл).
13. Осадок цвиттериона 9 был перенесен в 250 мл одногорлую круглодонную колбу и тщательно высушен в вакуумной печи при 40 *C в течение ночи с получением светло-фиолетового твердого вещества; выход: 19,2 г (63%).
2. Смесь дегазировали и долили N2.
3. Добавили 10% Pd/C (1,1 г), смесь дегазировали и наполнили шаром H2 при 1 атм.
4. Реакционную смесь перемешивали в течение ночи при температуре rt.
5. Колбу дегазировали, долили N2 и отфильтровали суспензию через целит через воронку Бюхнера.
6. Фильтр промыли CH3OH (500 мл), а окрашенный в фиолетовый цвет фильтрат сконцентрировали и высушили в течение ночи в вакууме, получив 10,7 г неочищенного 1 (106%).
7. Сырое твердое вещество суспендировали в i-PrOH (200 мл) и кипятили в течение 30 мин, затем отфильтровали в горячем виде (50-60 *C).
8. Собранное твердое вещество промыли ацетоном и получили твердое вещество бледно-фиолетового цвета.
9. Фиолетовое твердое вещество суспендировали в 25% CH3OH/i-PrOH, кипятили 30 мин и отфильтровывали в горячем виде, промывая 25% CH3OH/i-PrOH, чтобы получить светло-фиолетовое твердое вещество.
10. Наконец, твердое вещество перекристаллизовали из 30% H2O в ацетоне и отфильтровали, получив светло-голубые иглы.
11. Дальнейшая перекристаллизация из 30% ацетона/воды дала бесцветные иглы.
12. Окончательная перекристаллизация из деионизированной H2O (~50 мл) дала белое твердое вещество, которое сушили в печи при 60 *C в течение двух дней, чтобы получить белое твердое вещество; выход: 4,9 г (49%).

Бензил {3-[2-(Бензилдиметиламмонио)этил]-1H-индол-4-ил} Фосфат.
1. В круглодонную колбу, оснащенную верхней мешалкой, терморегулятором и капельной воронкой, добавляют псилоцин (10,3 г, 60,2 ммоль) и ангид THF (500 мл).2. Смесь перемешивали в течение 15 мин и погрузили колбу в охлаждающую баню с твердым CO2/ацетоном при -78 *C.
3. Когда внутренняя температура реакции достигла -67 *C, раствор 2,5M BuLi в гексанах (28,9 мл, 72,3 ммоль) добавляли по каплям в течение нескольких минут и поддерживали показания внутренней температуры ниже -60 *C.
4. После перемешивания оливково-зеленой реакционной смеси в течение 10 минут, тетрабензилпирофосфат (35,7 г, 66,2 ммоль) добавили одной порцией и смесь хорошо перемешали.
5. Через 1,5 ч баню с твердым CO2/ацетоном удалили и дали температуре медленно подняться до -25*C в течение 2 ч.
6. Аминосвязанный силикагель (30 г) добавили одной порцией и реакцию разбавили EtOAc (600 мл).
7. Темную смесь отфильтровали через прокладку Celite и промыли EtOAc (400 мл).
8. Кек повторно перемешивали в течение 10 мин с EtOAc (400 мл) и снова отфильтровывали.
9. Объединенные фильтраты концентрируют и переносят в 500 мл одногорлую круглодонную колбу.
10. Серое масло повторно растворили в DCM (100 мл) и нагревали с помощью тепловой пушки до кипения в течение 5 мин.
11. Колбе дали дойти до температуры rt и затем оставили на ночь при 4*C.
12. Неочищенный серовато-окрашенный осадок цвиттериона 9 отфильтровали через воронку Бюхнера, затем тритурировали с DCM (4x100 мл).
13. Осадок цвиттериона 9 был перенесен в 250 мл одногорлую круглодонную колбу и тщательно высушен в вакуумной печи при 40 *C в течение ночи с получением светло-фиолетового твердого вещества; выход: 19,2 г (63%).
Псилоцибин.
1. В круглодонную колбу объемом 2000 мл добавляют бензил {3-[2-(бензилдиметиламмонио)этил]-1H-индол-4-ил}фосфат (16,9 г, 35,6 ммоль), затем CH3OH (1200 мл).2. Смесь дегазировали и долили N2.
3. Добавили 10% Pd/C (1,1 г), смесь дегазировали и наполнили шаром H2 при 1 атм.
4. Реакционную смесь перемешивали в течение ночи при температуре rt.
5. Колбу дегазировали, долили N2 и отфильтровали суспензию через целит через воронку Бюхнера.
6. Фильтр промыли CH3OH (500 мл), а окрашенный в фиолетовый цвет фильтрат сконцентрировали и высушили в течение ночи в вакууме, получив 10,7 г неочищенного 1 (106%).
7. Сырое твердое вещество суспендировали в i-PrOH (200 мл) и кипятили в течение 30 мин, затем отфильтровали в горячем виде (50-60 *C).
8. Собранное твердое вещество промыли ацетоном и получили твердое вещество бледно-фиолетового цвета.
9. Фиолетовое твердое вещество суспендировали в 25% CH3OH/i-PrOH, кипятили 30 мин и отфильтровывали в горячем виде, промывая 25% CH3OH/i-PrOH, чтобы получить светло-фиолетовое твердое вещество.
10. Наконец, твердое вещество перекристаллизовали из 30% H2O в ацетоне и отфильтровали, получив светло-голубые иглы.
11. Дальнейшая перекристаллизация из 30% ацетона/воды дала бесцветные иглы.
12. Окончательная перекристаллизация из деионизированной H2O (~50 мл) дала белое твердое вещество, которое сушили в печи при 60 *C в течение двух дней, чтобы получить белое твердое вещество; выход: 4,9 г (49%).
Химия триптамина. Факты, свойства, синтез.
Введение в химию триптамина.
Триптамин - это органическое соединение, которое служит основой для широкого спектра биологически активных молекул. Встречаясь в природе в различных формах, от нейротрансмиттеров, таких как серотонин, до психоделиков, таких как псилоцибин, триптамин является предметом обширных исследований и дебатов. Его присутствие в многочисленных биологических путях делает его молекулой, представляющей значительный интерес как для химии, так и для биологии. Цель этой статьи - дать обзор химии триптамина, включая его физические и химические свойства, пути синтеза, биологическое значение, применение и проблемы безопасности.
Триптамин гидрохлорид.
Физико-химические свойства триптамина.
Триптамин, индольный алкалоид, имеет структуру, характеризующуюся бициклической индольной кольцевой системой, присоединенной к этиламиновой цепи. Давайте углубимся в его физические и химические свойства:Молекулярная структура:
Базовая структура триптамина состоит из плоского индольного ядра, которое представляет собой бензольное кольцо, соединенное с пиррольным кольцом, и боковой цепи этиламина, исходящей из азота пиррола. Эта структура лежит в основе многих природных и синтетических соединений.

Схема триптамина.
Физические свойства:
Состояние и внешний вид: Обычно триптамин представляет собой белое или слегка желтое кристаллическое вещество.
Температура плавления: Температура плавления триптамина колеблется в пределах 113-116 °C.
Температура кипения: температура кипения составляет примерно 378 °C.
Растворимость: Несмотря на хорошую растворимость в органических растворителях, таких как этанол и хлороформ, он ограниченно растворим в воде.
Химическая реактивность:
Индольное кольцо триптамина может вступать в реакции электрофильного и нуклеофильного замещения, особенно в 3-положении, благодаря концентрации электронов. Боковая цепь этиламина также является местом для реакций, включая алкилирование и ацилирование.
Значение pKa:
Триптамин имеет значение pKa, близкое к 10,6 для его конъюгированной кислоты, что говорит о том, что при физиологическом pH значительная часть существует в протонированной форме.
Стабильность:
Триптамин чувствителен к окислению, особенно в присутствии воздуха и света. При окислении он может образовывать различные продукты, включая производные красителя индиго.
Химическое поведение:
На его поведение в основном влияет взаимодействие между богатым электронами индольным кольцом и аминной функциональной группой. Этот баланс определяет его реакции, связывание с рецепторами в биологических системах, а также его роль в качестве предшественника более сложных молекул.
Синтетические пути к триптаминам.
Триптамин, обладающий интригующей молекулярной структурой, вызывает интерес химиков-органиков уже несколько десятилетий. Со временем были разработаны различные методы синтеза, позволяющие получать триптамин как эффективно, так и экономично. Вот несколько подробных маршрутов синтеза триптамина:1. Декарбоксилирование триптофана
Один из самых традиционных маршрутов предполагает получение триптофана из аминокислоты.
Метод: Триптофан подвергается декарбоксилированию, обычно под воздействием тепла или специальных катализаторов, в результате чего образуется триптамин.
Преимущества: Этот метод прост и использует легкодоступный исходный материал.
Недостатки: Процесс может быть несколько неэффективным и требовать высоких температур.

Декарбоксилирование триптофана.
2. Метод восстановления 3-(2-нитровинил)индола
3-(2-Нитровинил)индол плохо растворим в эфире, однако, используя так называемую технику экстракции Сокслета, его можно восстановить до триптамина.

Метод восстановления 3-(2-нитровинил)индола.
15 г 3-(2-нитровинил)индола экстрагируют в течение 8 часов из наперстка Сокслета в колбу, содержащую 15 г гидрида алюминия лития, растворенного в 300 мл безводного эфира. Смесь обрабатывают 80 мл воды, медленно и с охлаждением, и фильтруют. Эфирный раствор отделяют, сушат над сульфатом натрия и насыщают хлористым водородом. Получено 12,7 г гидрохлорида триптамина. После кристаллизации из метанола-этилацетата гидрохлорид триптамина плавится при 249-250°С.
3. Ферментативный путь
С ростом интереса к "зеленой" химии ферментативный синтез стал привлекательным вариантом.
Метод: Ферменты, такие как триптофандекарбоксилаза, могут быть использованы для преобразования триптофана в триптамин в биокаталитических процессах.
Преимущества: Эти маршруты более экологичны и часто могут проводиться в мягких условиях.
Недостатки: Ферментативные методы могут быть более медленными, а поиск или производство нужного фермента может оказаться сложной задачей.
По мере продолжения исследований, вероятно, будут разработаны более эффективные, экономичные и экологичные методы синтеза триптамина. Выбор того или иного метода часто зависит от желаемого выхода, чистоты и специфических требований исследовательского или промышленного проекта.
Биологическое значение триптамина.
Триптамин, несмотря на кажущуюся простоту строения, играет огромную роль в биологии, являясь основной структурой огромного количества физиологически значимых соединений.Нейротрансмиттеры и нейромодуляторы:
В первую очередь триптамин служит предшественником серотонина - ключевого нейромедиатора, регулирующего настроение, аппетит и сон, а также другие физиологические процессы. Аналогичным образом, мелатонин, играющий ключевую роль в регулировании циркадных ритмов и циклов сна, также берет свое начало в биохимии триптамина.
Эндогенное присутствие:
Хотя следовые количества триптамина обнаруживаются в естественном виде в человеческом мозге, его точная роль до сих пор остается предметом исследований. У некоторых видов беспозвоночных триптамин действует непосредственно как нейротрансмиттер.
Психоактивные производные:
Помимо роли предшественника, триптаминовый скелет также является основой для нескольких психоактивных соединений. Такие соединения, как ДМТ (диметилтриптамин) и псилоцибин, содержащиеся в различных растениях и грибах, оказывают глубокое воздействие на сознание человека и являются объектами как традиционного использования в коренных культурах, так и современных научных исследований.
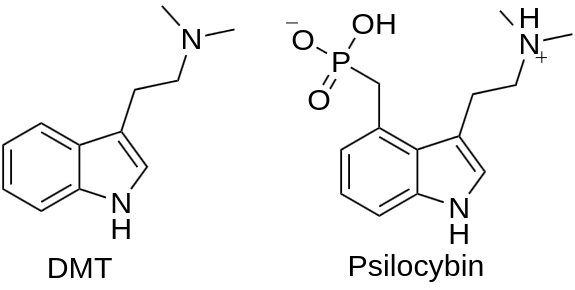
ДМТ и псилоцибин - психоактивные производные триптамина.
Ферментативные пути:
Биологические превращения триптамина осуществляются с помощью ряда ферментов. Например, в превращении триптамина в серотонин участвует фермент декарбоксилаза ароматических L-аминокислот. Эти ферментативные пути подчеркивают встроенную роль триптамина в сложные биохимические сети.
Замысловатый танец триптамина в биологических системах подчеркивает его значение не только как самостоятельного вещества, но и как основополагающего компонента в широком спектре биологически активных молекул. Это делает его молекулой, представляющей огромный интерес для исследователей самых разных дисциплин - от биохимии до фармакологии и нейронаук.
Применение триптамина.
Разнообразная структура и биологическая значимость триптамина открыли двери для множества применений, как в научных исследованиях, так и в медицине.1. Фармацевтические исследования:
Одной из основных областей, где триптамин оказался незаменим, является фармацевтический сектор.
Антидепрессанты: Тесная связь триптамина с серотонином, нейротрансмиттером, регулирующим настроение, делает его центральным звеном в синтезе некоторых антидепрессантов.
Лекарства от мигрени: Некоторые производные триптамина были изучены на предмет их потенциала в лечении мигрени благодаря их сосудистым эффектам.
Антигипертензивные средства: Некоторые производные триптамина продемонстрировали свойства, которые делают их перспективными кандидатами в качестве антигипертензивных препаратов.
2. Неврологические исследования:
Учитывая его присутствие и множество производных в нервной системе, триптамин является краеугольным камнем в неврологических исследованиях.
Психоделические исследования: Такие соединения, как ДМТ, имеющие триптаминовую структуру, в настоящее время изучаются на предмет их потенциального терапевтического применения, особенно в отношении психических расстройств, таких как депрессия, тревожность и посттравматическое стрессовое расстройство.
Иcследования нейротрансмиссии: Понимание роли триптамина и его взаимодействия с различными нейротрансмиттерными системами позволяет понять сложную работу мозга.
3. Химический прекурсор:
Модифицируемая структура триптамина делает его идеальной отправной точкой для синтеза широкого спектра органических соединений, как природных, так и синтетических. Его податливость в химических реакциях позволяет создавать разнообразные молекулы для различных исследований.
4. Традиционное и этноботаническое использование:
Триптамин и его производные, присутствующие в некоторых растениях и грибах, являются неотъемлемой частью различных традиционных практик, ритуалов и традиционных лекарств. Понимание этих способов использования может дать уникальное представление о человеческой психике и культурном значении этих соединений.
5. Биохимические анализы:
В области биохимии триптамин может служить субстратом в различных ферментативных анализах, помогая понять и охарактеризовать такие ферменты, как триптофангидроксилаза или декарбоксилаза.
Мириады применений триптофана - от клинического использования до глубоких психо-духовных переживаний - подчеркивают его многогранное значение в науке, медицине и культуре. По мере продолжения исследований, вероятно, появятся новые и захватывающие области применения, что еще больше укрепит значение триптамина в различных областях.

Триптамин психодинамическое искусство.
Обращение с триптаминами, безопасность и правила.
Учитывая биологическую активность триптамина и его производных, работа с ними строго регламентирована. Меры безопасности включают использование средств индивидуальной защиты и вытяжных шкафов при работе с соединением в лабораторных условиях. Кроме того, хранение, использование и утилизация триптамина регулируются различными ведомствами, в том числе Управлением по контролю за продуктами и лекарствами США. Неправильное использование триптамина или его производных может привести к юридическим последствиям.Заключение.
Триптамин стоит на уникальном перекрестке химии и биологии, покоряя ученых своей сложной структурой и биологическим значением. Являясь основой для многочисленных физиологически активных соединений, он играет важную роль в органической химии, медицине и нейронауках. Будущие исследования обещают раскрыть его потенциальные возможности применения и углубить наши знания о его сложной роли в различных системах.Конвертер валют
Пользователи онлайн
- 14nd24
- Amplitude
- XenonTrip
- QuantumReagent
- NeuroSynth
- HalogenHex
- Hoffmanic
- Доктор Трип
- Ket0Synth
- Etherwave
- Dr. Shulgin
- OMNIA
- Изомерист
- Ацетатник
- Бромбензенов
- Пирролидоныч
- Псевдоэфирыч
- Стереоизом
- Гомологист
- Альдегидыч
- Оксиматор
- Триазольщик
- Лаббро
- Анархимик
- Бромэтиламин
- Метиламинатор
- АльфаФенил
- Реаптаксер
- lesleyadrian
- Serotonaut
- DimethylX
- Benzyne
- MoleculeMind
- Синаптин
- Карбончик
- Кетонятор
- Фенилбрат
- ИзоПара
- Реакторщик
- Хлорбутан
- Толуолкин
- Нитролаб
- Диметилацетат
- Оргасинтез
Всего: 56 (пользователей: 44, гостей: 12)