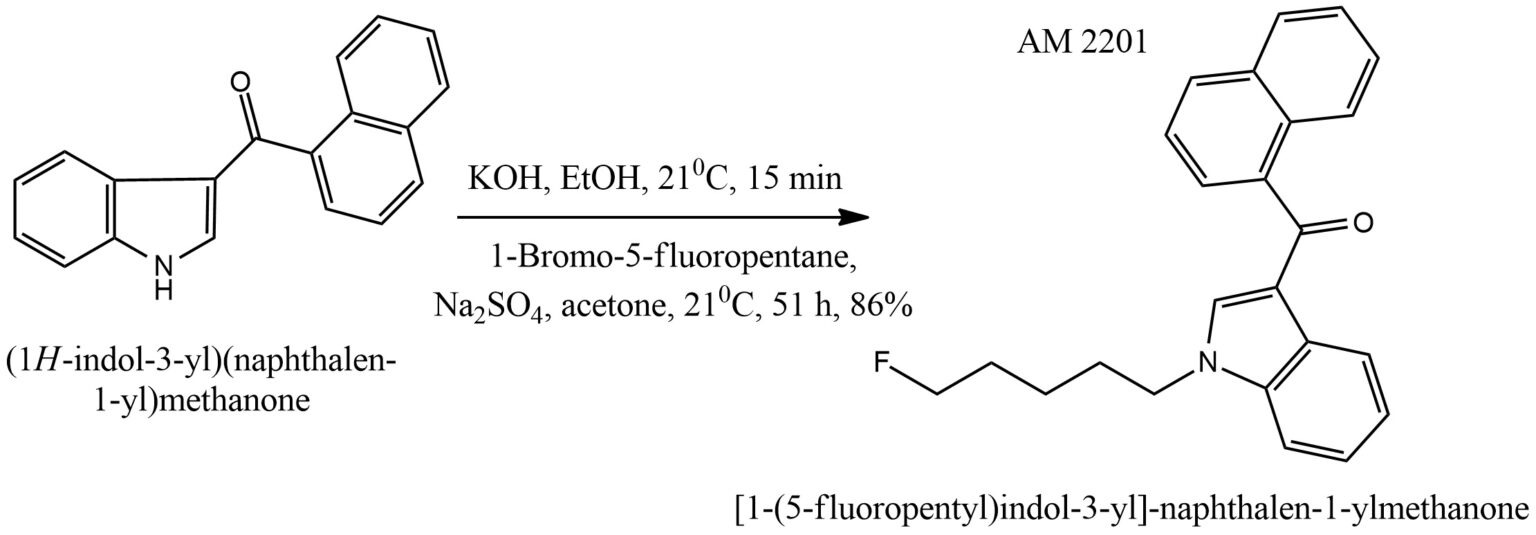
Процесс создания препарата.
Казалось бы, все уже давно знают, как создается новое лекарство, особенно после Ковид-19, когда все наблюдали за теми самыми клиническими испытаниями вакцин. Однако все не так просто. В двух словах - в этой публикации вы узнаете, как долго длится процесс создания лекарства и насколько он дорог. И, возможно, вы догадаетесь, что если по телевизору говорят, что ученые открыли вещество, способное победить рак или какую-то другую болезнь, то бежать в аптеку в надежде купить это новое лекарство пока рано.
Идея.
Для того чтобы ученые или фармацевтическая фирма начали разработку лекарства, необходимо сочетание нескольких факторов.
Социальная значимость заболевания.
Известные молекулярные механизмы развития болезни.
Финансовые ресурсы и возможность создать конкретное лекарство.
Другими словами, должна быть идея.
Что представляет собой "мишень" для лекарства?
Команда ученых вместе выбирает мишень и способ воздействия на нее для лечения или профилактики заболевания.
Мишень для лекарства - это биологическая макромолекула, связанная с определенной функцией, нарушение которой приводит к заболеванию. Наиболее распространенными мишенями для лекарств являются белки - рецепторы и ферменты. На инфографике показано, на какие макромолекулы чаще всего нацелены лекарства. Забегая вперед, отметим, что вещество - лекарство - затем подбирается к "мишени". Самый распространенный пример - циклооксигеназа 1 (мишень) и ацетилсалициловая кислота (лекарство).
Поиск лигандов.
После того как ученые нашли мишень для лекарства, им нужно понять, чем в нее "целиться". Лиганд (потенциальное лекарство) - это химическое соединение (обычно низкомолекулярное), которое специфически взаимодействует со своей мишенью и тем самым влияет на процессы внутри клетки.
Изучить все возможные вещества, конечно, нереально: существует не менее 1 040 лигандов. Поэтому на структуру потенциальных лигандов накладывается ряд ограничений, что значительно сужает круг поиска.
В качестве отправной точки обычно используются библиотеки соединений, которые создаются специализированными компаниями по условиям, заданным разработчиком, или уже имеются в арсенале фармацевтической компании. Такие библиотеки могут содержать миллионы веществ.
Первоначально скрининговый анализ помогает определить, влияют ли выбранные лиганды на исследуемую мишень. Скрининговый анализ может быть лабораторным (in vitro) или компьютерным (in silico).
Лабораторный скрининг.
На специальных предметных стеклах робот выкачивает тестовые вещества из пипеток, следуя заранее заданной программе.
Слайды представляют собой пластины с лунками, содержащими тысячи микролитров различных целевых белков или целых генетически модифицированных клеток.
Затем происходит считывание показаний, определяющее, в какой лунке обнаружена биологическая активность. Детектор может определять ее по радиоактивному сигналу, флуоресценции, поляризации света и многим другим параметрам.
Оптимизация.
Из тысяч доступных веществ с определенными свойствами необходимо отобрать сотни молекул, способных после дальнейшей модификации и тестирования на бактериях или клеточных культурах дать десятки соединений-"кандидатов", предназначенных для доклинических исследований, в том числе на животных.
Оптимизация может заключаться в "отсечении" части известного лиганда или, наоборот, добавлении к нему новых элементов и новом тестировании на взаимодействие с мишенью. Возвращаясь к аспирину: он получен из салициловой кислоты путем добавления ацетильной группы.
Базовые испытания.
Отобранные соединения сначала проверяются в биохимико-фармакологических исследованиях или экспериментах на клеточных культурах, изолированных клетках и изолированных органах.
Поскольку эти модели не способны полностью воспроизвести весь спектр биологических процессов в реальном организме, любой потенциальный препарат тестируется на животных. Только эксперименты на животных могут ответить на вопрос, проявляются ли желаемые эффекты при нетоксичных или малотоксичных дозах.
Исследование токсичности оценивает следующие параметры.
Токсичность при кратковременном и длительном применении.
Возможность генетического повреждения (генотоксичность, мутагенность).
Возможность развития опухолей (онкогенность и канцерогенность).
Возможность рождения больного плода (тератогенность).
На животных исследуемые соединения также проверяются на всасывание, распределение, метаболизм и выведение (фармакокинетика).
После этого этапа отсева до стадии клинических испытаний на людях остается в лучшем случае 1-3 препарата (напомним, что изначально существовало около 1000 потенциальных лекарств!).
Выход на рынок.
Клинические испытания включают несколько этапов, которые иллюстрирует инфографика.
Сначала новые препараты тестируются на здоровых людях, чтобы определить, наблюдаются ли эффекты, обнаруженные в опытах на животных, у людей, и выявить зависимость "доза-эффект".
Затем потенциальный новый препарат тестируется на отобранных пациентах, чтобы определить терапевтическую эффективность при том заболевании, для лечения которого он предназначен. Положительный эффект должен быть очевидным, а нежелательные эффекты - незначительными.
Далее в исследование включаются большие группы пациентов, у которых исследуемый препарат сравнивается со стандартным лечением по терапевтическим показателям.
В процессе клинических испытаний многие новые препараты оказываются непригодными для использования.
Решение об одобрении нового препарата принимает национальный регуляторный орган (FDA). Заявители (фармацевтические компании) представляют в регулирующий орган полный комплект документации по доклиническим и клиническим исследованиям, в которых полученные данные по эффективности и безопасности соответствуют установленным требованиям и предполагаемой форме выпуска препарата (таблетки, капсулы и т. д.).
После одобрения новый препарат может продаваться под торговой маркой и, таким образом, становится доступным для назначения врачами и распространения в аптеках. Одновременно разрабатывается технологический процесс производства препарата, требования к качеству и методы анализа.
По мере распространения препарата продолжается его мониторинг. Окончательное суждение о соотношении пользы и риска нового препарата может быть вынесено только на основании многолетнего опыта его применения. Именно так определяется терапевтическая ценность нового препарата.
В разных случаях процесс разработки нового препарата от идеи до внедрения занимает от 5 до 18 лет. Общая стоимость разработки, включая препараты, не вышедшие на рынок, часто превышает 1 млрд долларов (в среднем до 2,5 млрд долларов).
Идея.
Для того чтобы ученые или фармацевтическая фирма начали разработку лекарства, необходимо сочетание нескольких факторов.
Социальная значимость заболевания.
Известные молекулярные механизмы развития болезни.
Финансовые ресурсы и возможность создать конкретное лекарство.
Другими словами, должна быть идея.
Что представляет собой "мишень" для лекарства?
Команда ученых вместе выбирает мишень и способ воздействия на нее для лечения или профилактики заболевания.
Мишень для лекарства - это биологическая макромолекула, связанная с определенной функцией, нарушение которой приводит к заболеванию. Наиболее распространенными мишенями для лекарств являются белки - рецепторы и ферменты. На инфографике показано, на какие макромолекулы чаще всего нацелены лекарства. Забегая вперед, отметим, что вещество - лекарство - затем подбирается к "мишени". Самый распространенный пример - циклооксигеназа 1 (мишень) и ацетилсалициловая кислота (лекарство).
Поиск лигандов.
После того как ученые нашли мишень для лекарства, им нужно понять, чем в нее "целиться". Лиганд (потенциальное лекарство) - это химическое соединение (обычно низкомолекулярное), которое специфически взаимодействует со своей мишенью и тем самым влияет на процессы внутри клетки.
Изучить все возможные вещества, конечно, нереально: существует не менее 1 040 лигандов. Поэтому на структуру потенциальных лигандов накладывается ряд ограничений, что значительно сужает круг поиска.
В качестве отправной точки обычно используются библиотеки соединений, которые создаются специализированными компаниями по условиям, заданным разработчиком, или уже имеются в арсенале фармацевтической компании. Такие библиотеки могут содержать миллионы веществ.
Первоначально скрининговый анализ помогает определить, влияют ли выбранные лиганды на исследуемую мишень. Скрининговый анализ может быть лабораторным (in vitro) или компьютерным (in silico).
Лабораторный скрининг.
На специальных предметных стеклах робот выкачивает тестовые вещества из пипеток, следуя заранее заданной программе.
Слайды представляют собой пластины с лунками, содержащими тысячи микролитров различных целевых белков или целых генетически модифицированных клеток.
Затем происходит считывание показаний, определяющее, в какой лунке обнаружена биологическая активность. Детектор может определять ее по радиоактивному сигналу, флуоресценции, поляризации света и многим другим параметрам.
Оптимизация.
Из тысяч доступных веществ с определенными свойствами необходимо отобрать сотни молекул, способных после дальнейшей модификации и тестирования на бактериях или клеточных культурах дать десятки соединений-"кандидатов", предназначенных для доклинических исследований, в том числе на животных.
Оптимизация может заключаться в "отсечении" части известного лиганда или, наоборот, добавлении к нему новых элементов и новом тестировании на взаимодействие с мишенью. Возвращаясь к аспирину: он получен из салициловой кислоты путем добавления ацетильной группы.
Базовые испытания.
Отобранные соединения сначала проверяются в биохимико-фармакологических исследованиях или экспериментах на клеточных культурах, изолированных клетках и изолированных органах.
Поскольку эти модели не способны полностью воспроизвести весь спектр биологических процессов в реальном организме, любой потенциальный препарат тестируется на животных. Только эксперименты на животных могут ответить на вопрос, проявляются ли желаемые эффекты при нетоксичных или малотоксичных дозах.
Исследование токсичности оценивает следующие параметры.
Токсичность при кратковременном и длительном применении.
Возможность генетического повреждения (генотоксичность, мутагенность).
Возможность развития опухолей (онкогенность и канцерогенность).
Возможность рождения больного плода (тератогенность).
На животных исследуемые соединения также проверяются на всасывание, распределение, метаболизм и выведение (фармакокинетика).
После этого этапа отсева до стадии клинических испытаний на людях остается в лучшем случае 1-3 препарата (напомним, что изначально существовало около 1000 потенциальных лекарств!).
Выход на рынок.
Клинические испытания включают несколько этапов, которые иллюстрирует инфографика.
Сначала новые препараты тестируются на здоровых людях, чтобы определить, наблюдаются ли эффекты, обнаруженные в опытах на животных, у людей, и выявить зависимость "доза-эффект".
Затем потенциальный новый препарат тестируется на отобранных пациентах, чтобы определить терапевтическую эффективность при том заболевании, для лечения которого он предназначен. Положительный эффект должен быть очевидным, а нежелательные эффекты - незначительными.
Далее в исследование включаются большие группы пациентов, у которых исследуемый препарат сравнивается со стандартным лечением по терапевтическим показателям.
В процессе клинических испытаний многие новые препараты оказываются непригодными для использования.
Решение об одобрении нового препарата принимает национальный регуляторный орган (FDA). Заявители (фармацевтические компании) представляют в регулирующий орган полный комплект документации по доклиническим и клиническим исследованиям, в которых полученные данные по эффективности и безопасности соответствуют установленным требованиям и предполагаемой форме выпуска препарата (таблетки, капсулы и т. д.).
После одобрения новый препарат может продаваться под торговой маркой и, таким образом, становится доступным для назначения врачами и распространения в аптеках. Одновременно разрабатывается технологический процесс производства препарата, требования к качеству и методы анализа.
По мере распространения препарата продолжается его мониторинг. Окончательное суждение о соотношении пользы и риска нового препарата может быть вынесено только на основании многолетнего опыта его применения. Именно так определяется терапевтическая ценность нового препарата.
В разных случаях процесс разработки нового препарата от идеи до внедрения занимает от 5 до 18 лет. Общая стоимость разработки, включая препараты, не вышедшие на рынок, часто превышает 1 млрд долларов (в среднем до 2,5 млрд долларов).